AG Georg Kreimer
Photoorientierung begeißelter Grünalgen
Ziel unserer Forschung ist es die Funktionsweise des Augenfleck-Apparats der Grünalgen, dem „Auge“ dieser Zellen, zu verstehen. Dabei setzen wir eine Kombination aus verschiedenen zellbiologisch und biochemisch- molekularbiologischen Methoden ein. Aufgrund des Vorkommens von Rhodopsinen als Photorezeptoren in einigen Algengruppen und dem komplexen Aufbau dieser photorezeptiven Strukturen wird ihnen eine interessante Rolle bei der Evolution der Lichtwahrnehmung und Verarbeitung zugeschrieben. Die spezialisierten Rhodopsine sind die einzigen bisher bekannten direkt durch Licht aktivierbaren Ionenkanäle. Nach Etablierung der Isolation des Augenfleck-Apparats aus Grünalgen sowie der Charakterisierung des Proteoms und Phosphoproteoms (Schmidt et al. 2006, Plant Cell 18: 1908-1930; Wagner et al. 2008, Plant Physiol. 146: 772-788) interessieren wir uns nun besonders für die von diesem Zellorganell ausgehenden Signaltransduktionswege und die Mechanismen, die für den Zusammenhalt seiner unterschiedlichen subzellulären Komponenten verantwortlich sind. Unser derzeitiger Focus liegt dabei auf der funktionellen Charakterisierung von neuen Ca2+‑bindenden Proteinen sowie der Analyse von Protein-Protein-Interaktionen und Proteinkomplexen. Ein weiterer Schwerpunkt liegt auf der funktionellen Analyse der Photorezeptoren Channelrhodopsin 1 und Phototropin. Hierzu setzen wir unterschiedliche experimentelle Ansätze, wie z.B. RNAi, Phosphorylierungsanalysen, Immunopräzipitation und verschiedene 2D-Elektrophorese-Techniken in Kombination mit Massenspektrometrie, ein.
Als Modell-Organismus verwenden wir hauptsächlich die Grünalge Chlamydomonas reinhardtii. Einige Vorteile dieser Alge, neben denen von Mike Adams hervorgehobenen („Chlamydomonas is pretty, non-pathogenic, doesn´t stink, doesn´t contaminate other cultures and no one cares if you kill it.”), finden Sie hier.
- Obwohl eukaryotisch können mikrobielle Standardtechniken bei der Arbeit eingesetzt werden.
- Autothrophes, heterotrophes oder mixotrophes Wachstum in definierten Medien oder auf Agar ist möglich. Die Kultur ist einfach und es können schnell größere Mengen herangezogen werden. Unsere Anzucht-Möglichkeiten erlauben z.B. die Kultur von bis zu 100 L pro Woche unter sterilen Bedingungen.
- Das Wachstum kann bei Bedarf synchronisiert werden.
- C. reinhardtii kann sich sowohl vegetativ als auch geschlechtlich vermehren. Die geschlechtliche Vermehrung kann gezielt durch N-Mangel und Blaulicht induziert werden.
- C. reinhardtii ist genetisch gut charakterisiert. Alle drei Genome (Kern, Chloroplast, Mitochondrium) sind bekannt und können mit sehr einfachen Techniken stabil transformiert werden. Entsprechend gibt es eine Vielzahl von Mutanten.
- Eine Vielzahl von Mutanten, BAC- und cDNA-Banken, DNA-Chips etc. kann über das Chlamydomonas Center in den USA bezogen werden.
- Die Zellen sind motil und zu komplexen Informationsverarbeitungen fähig. Ihr Verhalten kann relativ einfach analysiert werden.
- Etliche Proteine weisen höhere Homologien zu Säugern anstatt zu Höheren Pflanzen auf. Somit ist C. reinhardtii beispielsweise auch ein Model für einige humane Krankheiten.
Einen Eindruck von dem Aufbau des Augenfleck-Apparats gibt Abbildung 1. Die ~ 1 µm2 große Struktur kommt in Einzahl in den Zellen vor und kann wegen der starken Anreicherung von Carotenoiden leicht lichtmikroskopisch erkannt werden. Detaillierte ultrastrukturelle und biophysikalische Untersuchungen haben gezeigt, dass der funktionelle Augenfleck-Apparat aus Bestandteilen mehrerer, subzellulärer Kompartimente besteht.
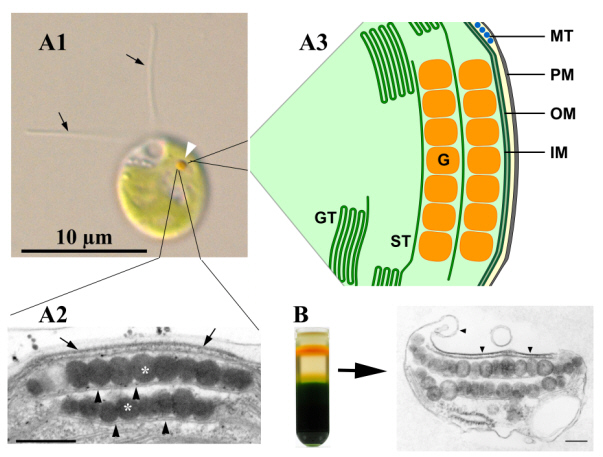
Auffälligster Bestandteil sind hexagonal angeordnete Lagen carotenoidreicher Lipid-Globuli innerhalb des Chloroplasten, die mit je einem Thylakoid assoziiert sind. Die äußerste Globuli-Schicht ist zusätzlich mit spezialisierten Bereichen der Chloroplasten-Hüllmembran und der Plasmamembran verbunden, sodass diese gesamte Einheit isoliert werden kann (siehe Abb. 1B). In den Bereichen der Plasmamembran und der äußeren Chloroplasten-Hüllmembran, die den Globuli aufliegen, ist eine hohe Dichte von Intramembranpartikeln feststellbar. Die biophysikalische und sensorische Funktionsweise des Augenfleck-Apparats ist eng an die Bewegung der Zellen gekoppelt. Letztlich erlaubt diese Struktur in Kombination mit der Schwimmbewegung der Zelle eine exakte Bestimmung der Licht-Richtung und Intensität. Gleichzeitig dient sie zur maximalen Kontrastverstärkung des Lichtsignals am Sitz der Rhodopsine in der Plasmamembran. In letzter Zeit häufen sich daneben Hinweise, dass der Augenfleck-Apparat neben der Lichtwahrnehmung noch weitere wichtige Funktionen innehaben könnte.
Eine detaillierte Beschreibung der Struktur und Funktion dieses „Auges“ der Grünalgen finden Sie in folgendem Übersichtsartikel (Kreimer 2009, Curr. Genet. 55,19-43).
Mitarbeiter
Dr. Michaela Wolfram
Sandra Tauber (TA)
Hildegard Voll (TA)