AG Benedikt Kost
Mechanismus und Regulation des polaren Zellwachstums in Pflanzen
A. Forschungsfokus und experimentelle Modelle
Migration und morphologische Plastizität von Zellen in sich entwickelnden Pflanzenorganen werden durch die Gegenwart von Zellwänden massiv eingeschränkt. Speziell in Pflanzen spielt deshalb gerichtetes (polares) Zellwachstum eine zentrale Rolle in der Zell- und Organmorphogenese (Entwicklung). Vegetative Pollenschlauchzellen und apikale Zellen von Moos Protonema expandieren außerordentlich schnell und strikt polar (nur in eine Richtung) durch Spitzenwachstum, ein Prozess der auf massiver, zytoskelettabhängiger Sekretion von Zellwandmaterial spezifisch an der wachsenden Spitze beruht.
Wir verwenden Tabak Pollenschläuche und Physcomitrella patens Protonema als Modellsysteme zur Untersuchung von zellulären und regulatorischen Prozessen, die der zellulären Polarität und dem gerichteten Zellwachstum in Pflanzen zu Grunde liegen.
B. Kontrolle des Pollenschlauchwachstums durch Rac/Rop GTPasen
Kleine GTPasen aus der Rac/Rop Familie akkumulieren an der Plasmamembran (PM) spezifisch an der Spitze von Pollenschläuchen, und kontrollieren das polare Wachstum dieser Zellen (Abbildung 1; Kost et al. 1999). Pollenschlauch Rac/Rop GTPasen interagieren mit einer Lipidkinase, die für die Anreicherung des Signallipids Phosphatidylinositol 4,5- Bisphosphat (PI 4,5-P2) in der PM an der Pollenschlauchspitze verantwortlich ist (Abbildung 1; Kost et al. 1999).

GFP fusioniert mit Rac/Rop, oder mit der PH Domäne von Rn-PLCd1 (spezifischer PI 4,5-P2 Marker), akkumuliert an der PM spezifisch an der Pollenschlauchspitze. Die Expression von konstitutiv-aktivem (CA) Rac/Rop depolarisiert das Pollenschlauchwachstum, während dominant-negatives (DN) Rac/Rop diesen Prozess inhibiert (Kost et al. 1999). Abb.1 Transiente Expression von Rac/Rop Varianten oder GFP::PH (PI 4,5-P2 Marker) in Tabak Pollenschläuchen.
GFP fusioniert mit Rac/Rop, oder mit der PH Domäne von Rn-PLCd1 (spezifischer PI 4,5-P2 Marker), akkumuliert an der PM spezifisch an der Pollenschlauchspitze. Die Expression von konstitutiv-aktivem (CA) Rac/Rop depolarisiert das Pollenschlauchwachstum, während dominant-negatives (DN) Rac/Rop diesen Prozess inhibiert (Kost et al. 1999).
Pollenschlauch Rac/Rop GTPasen gehören zu der Rho Familie der kleinen GTPasen, die in Tiersystemen und in Hefe gut untersucht worden ist. Rho GTPasen in der aktiven, GTP gebundenen Konformation stimulieren typischerweise mehrere unterschiedliche Signalkaskaden, während diese Proteine im GDP gebundenen Zustand keine Signalfunktionen haben. Verschiedene Gruppen konservierter regulatorischer Proteine kontrollieren das Verhältnis, in dem GTP (aktiv) und GDP (inaktiv) gebundene Formen von Rho GTPasen in lebenden Zellen vorliegen (Abbildung 2).
Unsere Arbeit trägt zum besseren Verständnis funktioneller Interaktionen zwischen regulatorischen Proteinen und anderen Faktoren bei, die für die Aufrechterhaltung der Polarisierung des Rac/Rop Signalnetzwerkes an der Pollenschlauchspitze verantwortlich sind (Klahre et al. 2006, Helling et al. 2006, Klahre and Kost 2006). Außerdem erweitern wir aktuelles Wissen in Bezug auf die Signalkaskaden, die in Pollenschläuchen durch Rac/Rop Aktivität stimuliert werden (Kost et al. 1999; Kost 2008; Yalovsky 2008). Das Rac/Rop Signalnetzwerk in diesen Zellen beruht offensichtlich auf pflanzenspezifischen regulatorischen Mechanismen und Signaltransduktionswegen.
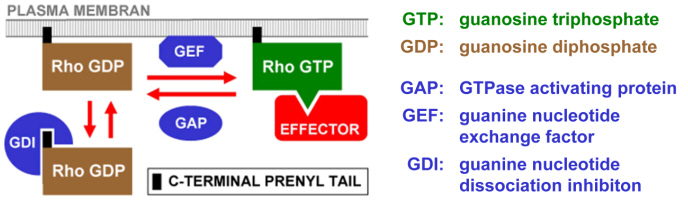
Posttranslationelle Prenylierung ist für die Bindung von Rho GTPasen an die PM verantwortlich. Im aktiven, GTP gebunden Zustand interagieren Rho GTPasen typischerweise mit mehreren Effektoren und stimulieren dadurch verschiedene Signalkaskaden. GAPs erhöhen die GTPase Aktivität von Rho GTPasen und inaktivieren dadurch die Signalfunktion dieser Proteine. GEFs fördern den Nukleotidaustausch und stimulieren Rho abhängige Signalkaskaden. GDIs transferieren GDP gebundene Rho GTPasen von der PM ins Zytoplasma.
C. Kontrolle des Spitzenwachstums in Moosen durch Rac/Rop GTPasen
Das Moos Physcomitrella patens ist die einzige gut etablierte Modellpflanze, die Transgene durch homologe Rekombination mit einer Frequenz in ihr Genom integrieren kann, die ausreicht, um Gene effektiv gezielt auszuschalten (knock-out) oder zu ersetzen (knock-in). Wegen dieser Eigenschaft und dank einer gut zugänglichen Genomsequenz eignet sich P. patens ausgezeichnet als ergänzendes experimentelles System zur Untersuchung des polaren Zellwachstums.
Eine von uns durchgeführte detaillierte Analyse hat gezeigt, dass das P. patens Genom für alle bekannten Proteine mit wichtigen Funktionen im Rac/Rop Signalnetzwerk kodiert, unter anderem für 4 fast identische Rac/Rop GTPasen (PpRop1-4; Abbildung 3; Eklund et al., 2010). Eine dieser Rac/Rop GTPasen (Pp-Rop1) fusioniert an GFP akkumuliert an der PM spezifisch an der Spitze apikaler Zellen von P. patens Protonema, die durch Spitzenwachstum expandieren (Abbildung 3). Die Funktionen aller Pp-Rop Proteine, sowie weiterer P. patens Proteine, die vermutlich eine Rolle in Rac/Rop abhängigen Signalkaskaden spielen, werden zur Zeit genauer untersucht.
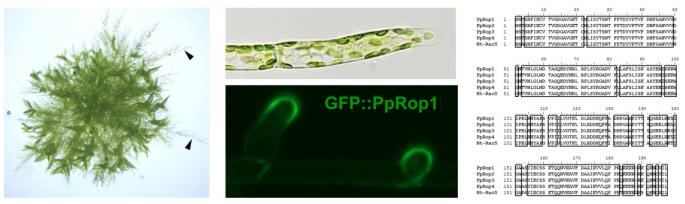
Verzweigte Protonema (links, Pfeile) wachsen aus einer P. patens Kolonie auf der Oberfläche von festem Kulturmedium. Die apikale Zelle am Ende jedes Protonemafilamentes (Mitte, oben) expandiert durch Spitzenwachstum. Die P. patens Rac/Rop GTPase Pp-Rop1 akkumuliert spezifisch an der Spitze von expandierenden apikalen Zellen (Mitte, unten). Pp-Rop1, die andern 3 P. patens Rac/Rop GTPasen und die Tabak Pollenschlauch Rac/Rop GTPase Nt-Rac5 haben fast identische Aminosäurensequenzen (rechts).
D. Wichtigste Ziele aktueller Forschung
- Aufklärung regulatorischer Mechanismen, die in gerichtet expandierenden Zellen das Rac/Rop Signalnetzwerk polarisieren
- Charakterisierung von Signalkaskaden, die in diesen Zellen durch Rac/Rop Aktivität stimuliert werden
- Identifizierung von zellulären Prozessen, die durch diese Signalkaskaden reguliert werden
Zur Erreichung diese Ziele setzen wir zellbiologische, molekularbiologische, biochemische und genetische Methoden zusammen mit mathematischer Modellierung ein.
Mitarbeiter
Dr. Maria Ntefidou
Joline Blaß (Doktorandin)
Carolin Fritz (Doktorandin)
Johanna Knab (Doktorandin)
Sylwia Schulmeister (TA)
Martin Schuster (TA)
Hildegard Voll (TA)
Publikationen
 |
 |
 |